ACTUALITES
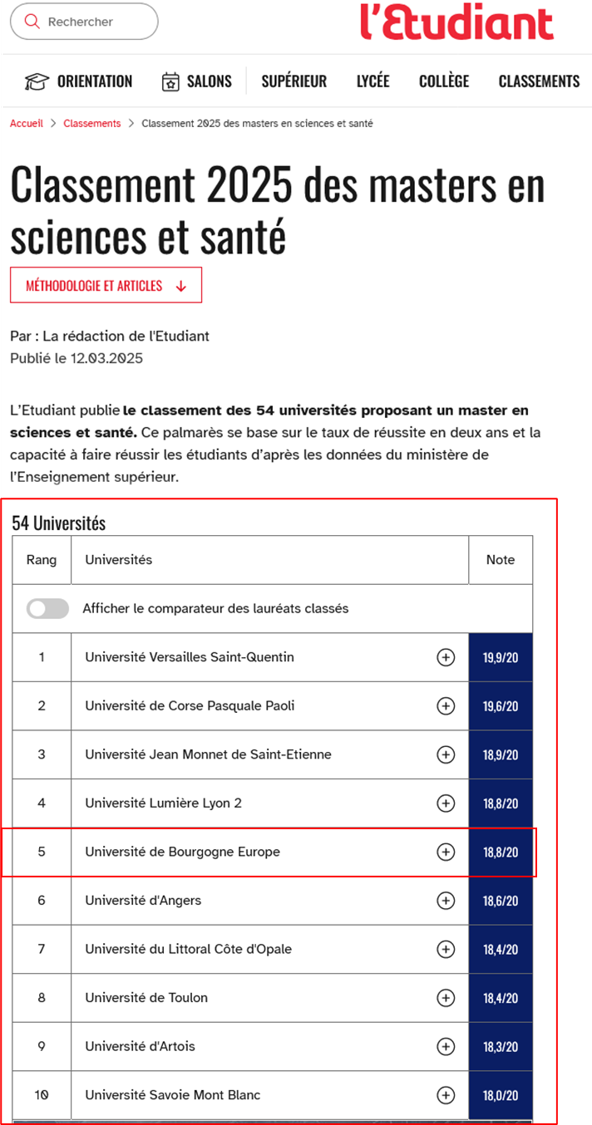
Master Sciences et Santé de l’UBE : TOP5 du classement 2025 l’Etudiant
Les candidatures sont ouvertes sur le plateforme Mon master (jusqu’au 24 mars)
https://monmaster.gouv.fr/formationMon
Promo M2 SCM 2024-2025
1er symposium SCM, organisé brillamment par les étudiants du M2.

Les étudiants du M2 SCM organisent leur 1er minisymposium SCM
Oncotrans 2024.
Les étudiants du M2 ont participé activement au congrès Oncotrans et ont remis un prix SCM du meilleur poster.

Rentrée 2025
Réunion de rentrée M2 SCM (pour étudiants inscrits à Dijon et à Besançon) : Lundi 9/09 – Amphi Ampère, UFR SVTE, Bâtiment Gabriel, DIJON / Teams
Réunion de rentrée M1 SCM Dijon : lundi 9/09 – Amphi 118, Bâtiment Gabriel, UFR SVTE, DIJON
Résultats du concours de l’Ecole Doctorale Environnement-Santé Dijon-Besançon
Belle réussite des étudiants du Master 2 SCM. Bravo à :
- Elodie Germain (1ère du concours Santé Dijon)
- Frédéric Montagnon (1er du concours Santé Besançon)
- Jason Bernauez (3ème du concours Santé Besançon
- Noémie Blanc (5ème du concours Santé Dijon)
- Léa Raimondo (6ème du concours Santé Dijon)
- Klopffer Hannah (6ème du concours Santé Besançon)
Campagne de candidature 2024-2025 à l’Université de Bourgogne
Les candidatures au master 2 SCM à l’Université de Bourgogne se feront sur ecandidat du 6 mai au 24 juin 2024.
Sujets stage 2024-2025 – M2R SCM
Appel à sujets
Date limite de dépôt des sujets de stage de master : 29 mars
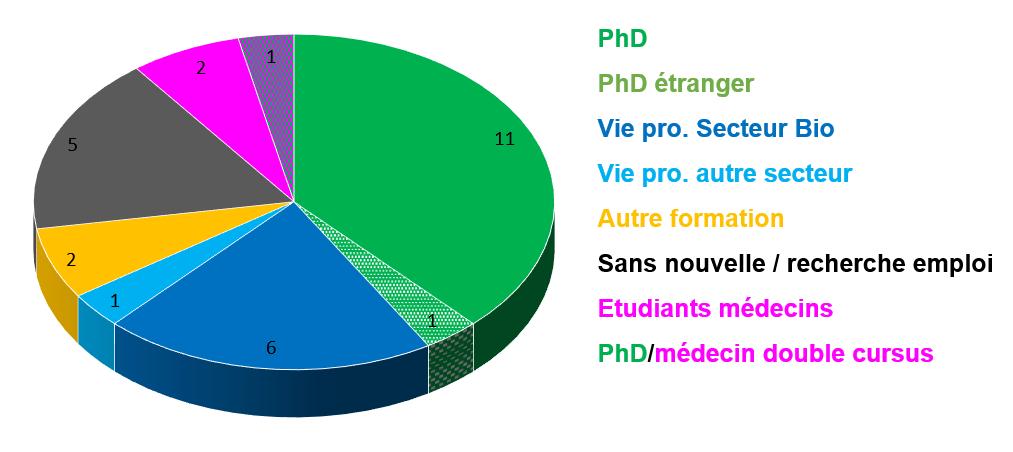
Promotion 2023 : que sont-ils devenus, 6 mois après leur diplôme ?
Belle réussite de la journée des masters. Une belle équipe pour l’accueil des étudiants. Un grand merci.


Journée des masters : Hall Gabriel, UFR SVTE Dijon. Jeudi 9/11 à partir de 9hrs

EuroMeP Symposium
Les étudiants du master 2 SCM à « EuroMeP Symposium », Dijon

Séminaire des « anciens » :
Dr Romain Aucagne, Ingénieur Recherche, Responsable de la plateforme CRIGEN,
CHU Dijon Bourgogne
Titre de l’intervention: « PRMTs »
Jeudi 21/10 à 10h15
RENTREE 2023 : lundi 11 septembre, 9hr, Amphi Courtois, Bâtiment Gabriel, UFR SVTE, Dijon
Emploi du temps 2023-2024
Résultats du concours de l’Ecole Doctorale Environnement-Santé Dijon-Besançon
Belle réussite des étudiants du Master 2 SCM. Bravo à :
- Chloé Mercier (1ère du concours Santé Besançon)
- Marvin Alvarez (1er du concours Santé Dijon)
- Emilien Laloy (2nd du concours Santé Besançon)
- Romain Barbosa (4ème du concours Santé Dijon)
- Jovanne Palvair (6ème du concours Santé Besançon)
La campagne de candidature au Master 2 SCM à  se déroulera du 24 avril au 12 juin sur la plateforme ecandidat (lien)
se déroulera du 24 avril au 12 juin sur la plateforme ecandidat (lien)
Sujets stage 2023-2024 (lien)
(La fiche « choix du stage » est à retourner avant le 23 juin au responsable de la formation).
10èmes Journées d’Immunologie Immunothérapie des Cancers à Dijon du 13 au 15 décembre 2022.

Séminaire des « anciens » :
Dr François Hermetet, Maître de conférence, Université de Bourgogne
Titre de l’intervention: De la connaissance de l’histoire naturelle des cancers au développement de stratégies
préventives et thérapeutiques innovantes
Jeudi 24/11 à 10h15
Séminaire des « anciens » :
Dr Jérome Perrard, Post-doc, New-York
Jeudi 17/11 à 15h45
Titre de l’intervention: Multiple E3 ligases control tankyrase stability and function
Séminaire :
Dr Arnaux Blomme, GIGA–Research Institute, Stem Cells unit, University of Liège.
Lundi 14/11 à 9hr
mTORC2 activation drives the reprogramming of lipid metabolism to support lung cancer progression
Lung cancer is a genetically heterogeneous disease characterized by a multitude of tumorpromoting alterations, such as mutations in the KRAS, EGFR and TP53 genes. This heterogeneity renders lung tumors resistant to current treatment strategies. Importantly, genomic amplification of RICTOR, the defining component of mTOR complex 2 (mTORC2), frequently occurs in lung cancer. Moreover, mTORC2 activation supports lung cancer progression and metastasis formation. Therefore, mTORC2 inhibition was initially suggested as a promising approach for the treatment of lung cancer. However, despite high clinical relevance, targeting mTORC2 activity in vivo remains challenging. Thus, uncovering novel mTORC2-dependent liabilities may represent a better option for the development of future therapies. In this study, we used a combination of proteomics, metabolomics and lipidomics to deeply
characterize the metabolic phenotype that is associated with mTORC2 activation (RICTOR expression) in lung cancer. We demonstrate that mTORC2 inhibition, achieved by genetic silencing of RICTOR, induces a profound rewiring of glucose and lipid metabolism in lung cancer cells and xenografts. In particular, we identified the transcription factor HIF-1β as a potential mTORC2 target whose expression consistently correlates with RICTOR levels. Using pharmacological and genetic inhibition of mTOR signaling, we further show that RICTOR controls HIF-1β expression through an mTORC2-PKC signaling axis, independently of AKT activity. Importantly, we demonstrate that HIF-1β significantly contributes to the mTORC2-dependent metabolic phenotype of lung cancer cells by regulating glucose and sphingolipid metabolism, in a process that also involves the aryl-hydrocarbon receptor (AhR). As a consequence, HIF-1β silencing in vivo strongly rewires tumor lipid metabolism in a model of lung cancer xenografts. Finally, we validated the clinical relevance of our findings by assessing correlations between RICTOR and HIF-1β in a genetic mouse model of lung-specific RICTOR overexpression, as well as in large cohorts of lung cancer patients. Taken together, our results support the rationale of targeting mTORC2-dependent lipid metabolism in lung cancer and highlight HIF-1β as a clinically relevant target for the development of future anticancer therapies.
Séminaire des « anciens » :
Dr Marine Jacquet, réactrice scientifique au sein de TransCure bioServices
Jeudi 13/10
OFFRES DE THESE & EMPLOI
- Des offres sont régulièrement publiées sur

- Academic positions https://academicpositions.fr/jobs/position/phd/country/france
 Institut de recherche en Immunologie et cancérologie, Montréal. Appel à candidature doctorat deadline en mars de chaque anné
Institut de recherche en Immunologie et cancérologie, Montréal. Appel à candidature doctorat deadline en mars de chaque anné
 Ecole Doctorale ES UBFC : Offres de thèse/emplois.
Ecole Doctorale ES UBFC : Offres de thèse/emplois.
 Diplôme d’ingénieur en Biotechnologie par la voie de l’apprentissage, ouvert aux étudiants titulaires d’un master 2 biologie.
Diplôme d’ingénieur en Biotechnologie par la voie de l’apprentissage, ouvert aux étudiants titulaires d’un master 2 biologie.
 Université de Genève : – PhD school of life sciences, Deadlines : 15 Avril / 15 Novembre
Université de Genève : – PhD school of life sciences, Deadlines : 15 Avril / 15 Novembre